Propyne
Le propyne est un composé insaturé aliphatique de formule chimique C3H4. C'est un gaz incolore très inflammable qui appartient à la famille des alcynes. C'est un des composés du MADP, avec son tautomère le propadiène avec lequel il est en équilibre. Ce mélange est utilisé pour le soudage et l'oxycoupage. Contrairement à l'acétylène, le méthylacétylène peut être compressé sans danger[10].
| Propyne | |||
| |||
| Identification | |||
|---|---|---|---|
| Nom UICPA | propyne | ||
| Synonymes |
méthylacétylène |
||
| No CAS | |||
| No ECHA | 100.000.754 | ||
| No CE | 200-828-4 | ||
| SMILES | |||
| InChI | |||
| Apparence | gaz comprimé incolore, d'odeur caractéristique[1]. | ||
| Propriétés chimiques | |||
| Formule | C3H4 [Isomères] |
||
| Masse molaire[3] | 40,063 9 ± 0,002 7 g/mol C 89,94 %, H 10,06 %, |
||
| Moment dipolaire | 0,784 ± 0,001 D[2] | ||
| Propriétés physiques | |||
| T° fusion | −102,7 °C[1] | ||
| T° ébullition | −23,23 °C[4] | ||
| Solubilité | dans l'eau : 3,6 g·l-1[1] | ||
| Masse volumique | 0,70 g·cm-3[1]
|
||
| Point d’éclair | Gaz Inflammable[1] | ||
| Limites d’explosivité dans l’air | 2,4–11,7 %vol[1] | ||
| Pression de vapeur saturante | à 20 °C : 521 kPa[1]
|
||
| Point critique | 5 628 kPa[6], 129,24 °C[4] | ||
| Thermochimie | |||
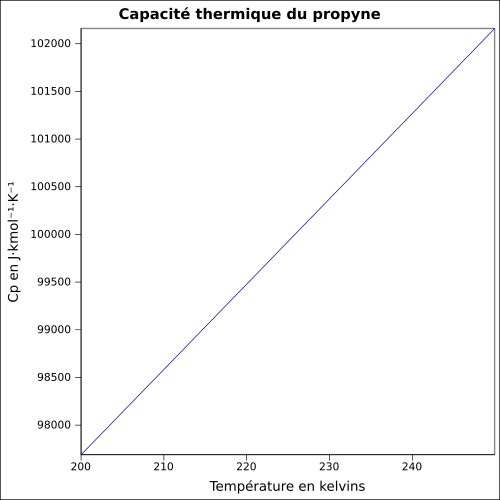
| Cp | |||
| Propriétés électroniques | |||
| 1re énergie d'ionisation | 10,37 ± 0,01 eV (gaz)[8] | ||
| Précautions | |||
| SIMDUT[9] | |||
  A, B1, |
|||
| NFPA 704 | |||
| Transport | |||
|
|||
| Unités du SI et CNTP, sauf indication contraire. | |||
| modifier |
|||
Propriétés
modifierLe propyne est un gaz relativement stable, quoique très inflammable. En grande concentration, il devient asphyxiant.
C'est un gaz incolore d'odeur caractéristique, plus lourd que l'air, presque insoluble dans l'eau.
Production et équilibre avec le propanediène
modifierLe méthylacetylène existe en équilibre avec le propadiène. Le mélange des deux gaz est appelé MAPD:
- H3CC≡CH = H2C=C=CH2, Keq = 0.22 (270 °C), 0.1 K (5 °C)
Le MAPD est un produit secondaire, souvent indésirable, du cracking du propane pour produire du propène, élément important dans l'industrie chimique[10]. Présent, il interfère en effet dans la polymérisation catalytique du propène (synthèse de polypropylène).
Utilisations
modifierEn chimie organique
modifierLe propyne est une molécule avec un squelette de trois atomes de carbone utile en synthèse organique. Sa triple liaison le rend très réactif, en particulier pour des réactions d'addition nucléophile.
Sa déprotonation avec le n-butyllithium donne le propynyl lithium. Ce dernier un réactif nucléophile qui peut réagir avec des groupes carbonyles pour produire des alcools et des esters[11]. Comme la purification du propyne coûte cher, on utilise généralement le gaz MAPD, meilleur marché[12].
Carburant pour fusée
modifierL'agence spatiale européenne, qui travaille sur des systèmes hydrocarbure léger/oxygène liquide comme mélange à haut rendement propulsif et qui seraient moins toxiques que le « classique » monométhylhydrazine/peroxyde d'azote, a montré que le propyne présentait de nombreux avantages comme carburant pour fusée pour des engins destinés à une orbite basse.
Notes et références
modifier- PROPYNE, Fiches internationales de sécurité chimique
- (en) David R. Lide, Handbook of chemistry and physics, Boca Raton, CRC, , 89e éd., 2736 p. (ISBN 978-1-4200-6679-1 et 1-4200-6679-X), p. 9-50
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Iwona Owczarek et Krystyna Blazej, « Recommended Critical Temperatures. Part I. Aliphatic Hydrocarbons », J. Phys. Chem. Ref. Data, vol. 32, no 4, , p. 1411 (DOI 10.1063/1.1556431)
- (en) Robert H. Perry et Donald W. Green, Perry's Chemical Engineers' Handbook, USA, McGraw-Hill, , 7e éd., 2400 p. (ISBN 0-07-049841-5), p. 2-50
- (en) Iwona Owczarek et Krystyna Blazej, « Recommended Critical Pressures. Part I. Aliphatic Hydrocarbons », J. Phys. Chem. Ref. Data, vol. 35, no 4, , p. 1461 (DOI 10.1063/1.2201061)
- (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams : Organic Compounds C8 to C28, vol. 1, Huston, Texas, Gulf Pub. Co., , 396 p. (ISBN 0-88415-857-8)
- (en) David R. Lide, Handbook of chemistry and physics, CRC, , 89e éd., 2736 p. (ISBN 978-1-4200-6679-1), p. 10-205
- « Méthylacétylène » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- Peter Pässler, Werner Hefner, Klaus Buckl, Helmut Meinass, Andreas Meiswinkel, Hans-Jũrgen Wernicke, Günter Ebersberg, Richard Müller, Jürgen Bässler, Hartmut Behringer, Dieter Mayer, "Acetylene" in Ullmann's Encyclopedia of Industrial Chemistry Wiley-VCH, Weinheim, 2007. 10.1002/14356007.a01 097.pub2
- Michael J. Taschner, Terry Rosen, and Clayton H. Heathcock, Ethyl Isocrotonate, vol. 7, page 226, 1990, CV7P0226
- US patent number 5744071, 1996, Philip Franklin Sims, Anne Pautard-Cooper, Processes for preparing alkynyl ketones and precursors thereof
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Propyne » (voir la liste des auteurs).